FluoroType®-Technologie - Die innovative Technologie mit hoher Sensitivität und maximaler Spezifität.
Aus dem Probenmaterial werden zuerst Nukleinsäuren isoliert, amplifiziert und anschließend mittels fluoreszenzmarkierter Sonden detektiert. Ampifikation und Detektion finden in einem optischen Thermocycler (FluoroCycler®) statt. Der FluoroType®-Technologie liegen verschiedene Methoden zugrunde:
PCR mit Hybridisierungssonden
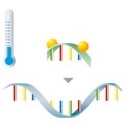  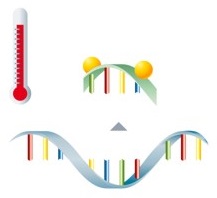 |
Nach der Amplifikation der Zielsequenzen erfolgt die Detektion mittels fluoreszenzmarkierter Sonden.
Liegen die Sonden im ungebundenen Zustand vor, kann der Fluorophor nicht zur Fluoreszenzemission angeregt werden. Während der anschließenden Schmelzkurvenanalyse lösen sich die Sonden bei einer spezifischen Temperatur wieder vom Amplifikat ab, was zu einer sofortigen Abnahme der Fluoreszenz führt. |
PCR mit Hydrolysesonden
 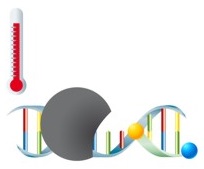 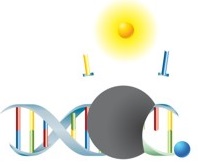 |
Die Detektion des Amplifikates erfolgt bei dieser Variation der Real-Time-PCR mittels Hydrolysesonden. Die Sonden verfügen über einen Fluorophor und einen Quencher. In ungebundenem Zustand findet keine Emission von Fluoreszenz statt, da sich beide Moleküle in räumlicher Nähe zueinander befinden. Während der Amplifikation lagern sich die Sonden an die Zielsequenzen an und werden in der Elongationsphase der PCR von der DNA-Polymerase hydrolytisch abgebaut. Fluorophor und Quencher der abgebauten Sonden werden freigesetzt und befinden sich so nicht mehr in räumlicher Nähe zueinander - das Fluoreszenzsignal kann nun detektiert werden. So kann in Echtzeit verfolgt werden, wie die Intensität der Fluoreszenz mit höherer Konzentration an freiem Fluorophor in der Reaktion ansteigt. Diese innovative Technologie bietet darüber hinaus die Möglichkeit zur Quantifizierung der Zielsequenzen. Die Quantifizierung von Erregern ist in der Klinik von großer Bedeutung, da sie nützliche Informationen für die Therapieplanung liefert. |
Asymmetric excess PCR mit Lights-On/-Off-Sonden
    |
Bei der LATE-PCR wird eine sogenannte asymmetrische PCR durchgeführt, das bedeutet einer der beiden Primer wird im Überschuss (Überschuss-Primer) zugegeben. Der zweite Primer wird nur in begrenzter Menge zugesetzt (limitierender Primer). Durch diese Limitation kommt es nach einer kurzen exponentiellen Phase (in der noch beide Primer zur Verfügung stehen) zu einer linearen Vermehrung eines einzelnen Nukleinsäure-Strangs – so entstehen einzelsträngige Amplifikate. Im Anschluss daran erfolgt die Detektion mittels Lights-On/-Off-Sonden: Die Lights-On/-Off-Sonden lösen sich nach der Hybridisierung mit dem Amplifikat bei einer für die jeweilige Sonde spezifischen Temperatur ab. Der Fluorophor der Lights-On-Sonden kann im ungebundenen Zustand nicht zur Emission von Fluoreszenz angeregt werden. Dadurch wird entweder Fluoreszenz emittiert oder unterdrückt, was in der Schmelzkurvenanalyse einen charakteristischen Kurvenverlauf ergibt. |